Proceso sencillo para evaluar la evolución de la fermentación malo láctica.
EL ácido málico, o
de la manzana, se diferencia del ácido tartárico, o de la uva, en que aquel tiene solo un grupo hidróxido.
- Ácido málico: COOH-CH(OH)-CH2-COOH masa molecular = 134
- Ácido tartárico: COOH-CH(OH)-CH(OH)-COOH masa molecular=150
Concentraciones altas de ácido málico en
los vinos tinto denotan un defecto en su elaboración. Aporta un sabor que recuerda a la sidra reineta, seco y áspero; quita suavidad a los caldos.
Además, en caso de que el vino se “vire” ligeramente, por un exceso de ácido acético, CH3-COOH, parte de éste
ácido volátil puede reaccionar con el etanol de la bebida dando un ester, el acetato de etilo,de olor “dulzón” lo que
aumenta aún más la sensación de que estamos ante un brebaje resultante de la fermentación de una mezcla
de uvas y manzanas.
En definitiva, especialmente en los vinos tintos de calidad, reducir al máximo el ácido
málico es un objetivo de la buena viticultura.
En los blancos
la presencia de concentraciones altas de ácido málico, en cambio,
es tolerable.
¿Cómo disminuye la presencia del málico?
En el seno de todos los vinos y en el ambiente hay
bacterias como la Oenococcus oeni capaces
de descomponer el ácido málico.
Como en las mayorías de las reacciones en presencia de poco oxígeno
la “oxidación” biológica produce ácido láctico y CO2 como residuos. Lo normal es que a continuación de la fermentación etílica comience la máloláctica. Por eso, interrumpir ésta antes de que haya concluido implica un merma de la
calidad. En muchas ocasiones, al carecer de método para evaluar este proceso el viticultor suele añadir los sulfitos reductores antes de tiempo, a fin de asegurar que no se inicia la nefasta oxidación etano acética que implicaría la ruina su ruina. Pero ello merma la calidad del vino.
Por eso es importante conocer el momento adecuado en que termina la fermentación malo láctica. Es el objetivo de este pequeño trabajo.
Por eso es importante conocer el momento adecuado en que termina la fermentación malo láctica. Es el objetivo de este pequeño trabajo.
El proceso maloláctica globalmente se indica por la reacción:
COOH-CH(OH)-CH2-COOH
= CO2 + COOH-CH(OH)-CH3
Acido
málico = dióxido de carbono + ácido láctico.
El metabolismo bacteriano reduce en pocos días la
concentración del á ido de la manzana. Ello conlleva una
ligera reducción de la acidez del vino, es decir,
un aumento de su pH. El láctico, con solo un
grupo ácido, es un ácido más débil que el málico
que posee dos grupos
ácidos, -COOH
.
La
fermentación malo láctica en
condiciones normales se
inicia a continuación de la transformación de la glucosa en
etanol. En esta primera fermentación se libera mucho más CO2 que en la segunda
fermentación. Luego, en la
malo-láctica se reduce su
burbujeo aunque no éste no desaparece.
Es la fase final del “hervor” del vino.
En
la comparación de las fórmulas de los ácidos tartárico y málico, vemos que éste tiene un oxígeno menos. La unión oxígeno – hidrógeno
constituye un dipolo eléctrico debido a la mayor electronegatividad
del átomo de oxígeno. Por eso, cuando más enlaces “-O-H” haya más
polares son las moléculas. Así, dichas sustancias interactúan mejor con las de agua ( unos de los mejores
dipolos eléctricos)
Así, las moléculas
del ácido tartárico están más unidas a la del agua (que en el
vino constituyen más del 75% del volumen) y , además, son algo
más pesadas que las del ácido málico. Esta propiedad es en la que
se fundamente la separación por cromatografía de los ácidos
tartárico y málico. El ácido láctico, además, es mucho más
liviano que los anteriores, solo tiene 3 carbonos. Por tantao es más fácilmente arrastrado
por un disolvente que por capilaridad, asciende en el papel, en la
tiza o en cualquier columna cromatográfica.
Esta propiedad,
junto a la variación del pH, las vamos a usar para evaluar la forma
cómo evoluciona la fermentación malo láctica.
Procedimiento 1.
Medida de la variación del pH.
Determinar la
variación del pH no es fácil. El ajuste del pH del vino, o de
cualquier otra disolución, no es sencillo. El pH varia con la
temperatura y el ajunte del pHmetro no siempre es fácil. En
definitiva técnica que haremos consiste en comparar la evolución
del pH del vino a lo largo de varios días. ( normalmente 7 días)
Antes que nada
debemos saber que el pHmetro deber guardarse siempre con su electrodo
sumergido en una disolución estándar de cloruro potásico en agua
destilada o cualquier otra disolución reguladora neutra. Ello
permitirá que no sea, en principio necesario, calibrarlo antes de
cada medición.
Inmediatamente
terminada la fermentación etílica, realizaremos las medidas
periódicas que sean necesario, habitualmente una por día. Como lo
normal es que, además del pHmetro, el bodeguero no tenga muchos
elementos de un laboratorio, procederemos de la forma siguiente.
- Se extraerá unos 24 mL del caldo cuando creamos que ha finalizado la primera fermentación. Se filtrará ese vino con papel de filtro ( se puede usar filtros de papel para café)
- Del vino filtrado extraeremos con una pipeta 10 mL del vino filtrado que se introducirán en una matraz aforado de 50 ml.
- Se llena con agua destilada el matraz hasta la linea que indica un volumen de 50 mL.
- A continuación se vuelca el contenido del matraz en un vaso pequeño, previamente secado con un secador de pelo con aire frio, que se ha lavado primero con agua normal y, luego enjuagado con agua destilada. Las huellas del agua del grifo, que tiene un pH básico, alterarían el pH de la disolución.
- Por otro lado hemos calentado en el micro ondas, directamente del termo o en un fogón unos 250 mL de agua (una escudilla) a una temperatura superior a los 40 0 50 ºC. Retiramos el recipiente y esperamos que la temperatura baje a unos 30ºC. Mediremos la temperatura con cualquier termómetro (clínico o de piscina).
- Se sumergirá el vaso donde hemos añadido la disolución de vino en agua destilada, como si fuera una especie de baño maría (termostato casero). Esperamos que la temperatura del agua exterior del baño maría esté alrededor de 30ºC para meter dentro el vaso con la disolución del vino. Esperamos que la temperatura descienda hasta los 26 -27ºC y, con el el pHmetro encendido mediremos le pH justo a los 25 ºC. Para ello, no tocaremos el vaso con los dedos pues aumentaríamos su temperatura. Anotamos en la libreta la fecha, la hora, la temperatura, que será normalmente 25ºC y el pH.
 Se repetirá en
los día siguientes idéntico procedimiento. Si todo va bien, las
disoluciones de vino irán progresivamente subiendo su pH
(reduciendo la acidez) hasta que esta se estabilice en dos o más
mediciones consecutivas. Si todas las medidas han sido correctas, la
estabilización del pH indicará el fin de la fermentación malo
láctica. Es el momento de hacer el trasvase y añadir el SO2 al
vino mediante gas, o con la combustión de la mecha de azufre o la
añadidura del metabisulfito potásico.
Se repetirá en
los día siguientes idéntico procedimiento. Si todo va bien, las
disoluciones de vino irán progresivamente subiendo su pH
(reduciendo la acidez) hasta que esta se estabilice en dos o más
mediciones consecutivas. Si todas las medidas han sido correctas, la
estabilización del pH indicará el fin de la fermentación malo
láctica. Es el momento de hacer el trasvase y añadir el SO2 al
vino mediante gas, o con la combustión de la mecha de azufre o la
añadidura del metabisulfito potásico.
- Si, ocurriese que llegado a un valor, se observara una disminución posterior del pH, estaríamos ante el inicio del indeseado “viraje” del vino o proceso acético. Si así fuere habría que parar esta oxidación etano acética bajando radicalmente la temperatura a la vez que añadiríamos el metabisulfito, ( encenderíamos la mecha ) o mediante cualquier procedimiento que garantice la interrupción de la oxidación.
La medida del pH está sujeta a las variaciones externas de la temperatura. También los valores obtenidos, por supuesto, dependen del ajuste inicial del aparato. Se suma a estas dificultades que
las variaciones del pH no suelen ser muy grandes. Por lo tanto, no
siempre es fácil realizar el método aquí descrito. Claro está que, con práctica y algo
de pericia y paciencia el método llega a ser eficaz.
Lo importante
no es el valor inicial del pH, sino su evolución. La acidez medida
de cada vino depende, por supuesto del ajuste del aparato,. El
valor real dependería de la naturaleza de la uva o mezclas de uva. Es
normal pHs iniciales alrededor de 2,5, el cual, a medida que se
procede a la fermentación maloláctica podrían alcanzar valores de
3 o, incluso un poco superiores.
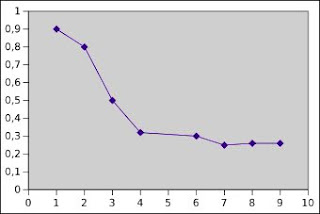
En la gráfica del pH frente a los días, se observa que a partir del 4 día deberá ya proceder al trasiego del vino.
En la gráfica del pH frente a los días, se observa que a partir del 4 día deberá ya proceder al trasiego del vino.
Procedimiento 2.
método cromatográfico casero.
La segunda forma de evaluar el fin de la fermentación malo-lactica
es quizá más fácil de hacer al ser menos sensible a las
variaciones externas. Ademas, tomaremos valores relativos, más
fiables que los absolutos como el caso de la medida del pH del método
anteriormente descrito.
La cromatografía es una gráfica en la que se observa la separación
de algunos componentes del vino; en este caso me refiero a los
diversos ácidos que los caldos poseen, principalmente los ácidos
tartários, málicos y lácticos, que se desplazaran caminos
distintos sobre un soporte inerte. En nuestro caso usaremos como
soporte o bien la tiza o el papel. dos.
Tanto una como otra poseen la capacidad de que el vino sea arrastrado
por un eluyente móvil que, desde la parte inferior asciende, gracias
a la adsorción (con d) capilar, arrastrando a alturas diferentes los
diversos ácidos. Existen en el vino otros muchos aunque en menor
cantidad, ( el pirúvico (butanodioico), el ascóbico o vitamina C,
el propanoico, el acético, el cítrico, etc), pero los ácidos que
vamos a tener en cuenta en nuestro experimento son tres, a saber, el
tartárico ,el málico y el láctico.
Estas tres moléculas tienen, en ese orden creciente, mayor capacidad
de avanzar sobre el soporte del cromatograma, es decir, el
papel, o, en su caso, la tiza.
En nuestro caso usaremos como fondo o soporte papel de filtro.Si
usáramos tiza, la misma, corriente, que se comercializa como prismas
blancos para las pizarras, la técnica sería prácticamente
idéntico; simplemente cambiaríamos el papel por la barrita de tiza.
El papel de filtro que se usa suele ser especial para cromatografía,
aunque podría usarse un papel cualquiera, incluso una cuartilla o
folio Dina 4, algo gruesa, incluso satinada o brillante. Claro que
,en todos los ensayos debemos usar el mismo tipo de papel (o la tiza
blanca cuadrada sacada de la misma caja) y la misma composición del
eluyente
Confección del
cromatógrafo.
Cortamos una tira de papel de unos 10 cm de ancho por unos 30 cm de largo. (aproximadamente un poco menor que el diámetro de la base del depósito que vamos a usar). Se dobla el papel un centímetro sobre una varilla (por ejemplo un lápiz) cuyo largo será mayor que el diámetro de la boca del depósito donde tendrá que apoyarse sin caer. La hoja del papel se doblará un centímetro sobre la varilla y se sujetará con dos trabas para tender la ropa.
- Se introducirá en el recipiente el líquido eluyente (una mezcla al 50% de agua y etanol con unas gotas de algunos indicadores ácido base) hasta que alcance una altura máxima de unos 2 cm sobre el fondo. El líquido, en su ascenso capilar a través del papel, arrastrará los componentes del vino a separar.
- El papel colgante se introducirá, posteriormente, en el depósito sumergiéndose su borde inferior aproximadamente 2 o 3 mm, no más, en el seno del del líquido eluyente.
- Antes de meter el papel en el depósito , a la altura de 1,5 cm del borde inferior , usando una regla como guía, se pondrán con un cuenta gotas, a la misma distancia, cinco o seis gotas de vino (las que quepan sin tocarse en el ancho del papel). Las manchas tendrán aproximadamente el mismo diámetro y no deben unirse entre sí.
- Al cabo del tiempo, una 5 o más horas, se retirará el papel y lo colgaremos hasta que se seque.
- Secado, veremos que aparece sobre el soporte la huellas de las manchas: diferentes franjas más o menos horizontales. El orden de estas bandas será: primera banda ancha que, si todo ha ido bien , corresponderá al ácido tartárico, el más abundante en el vino. Inmediatamente encima habrá otra banda que es la huella del ácido málico. Luego pueden haber varias bandas que no vamos a considerar en este análisis. La tercera banda que nos interesa es la que aparece en la parte superior que, es amarillenta y que corresponde al ácido láctico. La no aparición de esta banda en el primer análisis indicará que aún no se ha iniciado la fermentación malo láctica.
-
Ahora deberemos medir los valores relativos asociados a la concentración de cada uno de los ácidos. Para ello medimos con una regla, y en la misma zona el ancho de la primera, de la segunda y de la banda del láctico. Tenemos que tener claro la banda inferior del tartárico será en valores relativos del mismo ancho, desde el mosto al vino correctamente elaborado. Pues la concentración del ácido tartárico del vino no se alterará. ( A no ser que se produzca una precipitación de tartratos, lo que suele ocurrir si el depósito en que se elabora el el vino ha sido incorrectamente lavado con agua dura, con calcio). Con la calculadora dividiremos el tamaño de la altura o ancho vertical de la banda del ácido málico entre la altura o ancho de la banda del tartárico M=málico/tartárico. También haremos la relación entre el ancho de láctico y la banda del tartárico L=láctico/tartárico. Tanto M como L serán normalmente números entre 0 y 1.
- A medida que va procediéndose la fermentación malo-láctica, veremos como la relación M va disminuyendo y la relación L aumentando
 Cuando se alcance dos análisis consecutivos en los que M y L
permanezcan constante podremos considerar que la fermentación malo
láctica ha finalizado y procederemos a el trasiego del vino y el
proceso de conservación o estabilización mediante sulfuroso, en
sus diversas formas.
Cuando se alcance dos análisis consecutivos en los que M y L
permanezcan constante podremos considerar que la fermentación malo
láctica ha finalizado y procederemos a el trasiego del vino y el
proceso de conservación o estabilización mediante sulfuroso, en
sus diversas formas.
La composición del eluyente conviene que sea, en todos los ensayos, la
misma. Una sencilla que me ha dado resultados adecuados en muchos casos es la
siguiente :
un volumen de agua destilada(50%), por otro (50%) de etanol de 96º (de farmacia), unas gotas, 5, de rojo de resol y otras 5, de rojo de metilo.
Es conveniente usar siempre, la misma composición en todos los ensayos.
un volumen de agua destilada(50%), por otro (50%) de etanol de 96º (de farmacia), unas gotas, 5, de rojo de resol y otras 5, de rojo de metilo.
Es conveniente usar siempre, la misma composición en todos los ensayos.
Ambos indicadores “resaltan” las bandas de los ácidos incoloros
lo que facilita su “revelado”. La banda superior del cromatograma
corresponde al ácido láctico y se distingue fácilmente por su
color amarillento .
Las anchuras relativas de las bandas pueden variar por motivos
externos al margen de la composición. Por ejemplo el tipo de papel,
las pequeñas variaciones en la composición del eluyente, la
temperatura, la profundidad de inmersión del papel en el eluyente,
la duración del experimento etc. Por eso, el valor importante no es
esa anchura sino las relaciones M y L entre las bandas de málico y
de ácido láctico en relación al tartárico.
La gráfica indica cómo a partir del 7 día la fermentación malo láctica está concluida.
La gráfica indica cómo a partir del 7 día la fermentación malo láctica está concluida.
Julio Muñiz Padilla. Químico.